Новый закон может оставить малые города России без аптек
Общество 6894
ПоделитьсяС 1 сентября 2022 года большинство аптек в регионах могут оказаться под угрозой закрытия — новое положение о лицензировании фармдеятельности, которое вступает в силу, разрешает каждому индивидуальному предпринимателю лицензировать не более одной аптечной точки.
В июле индивидуальные предприниматели начали получать от Росздравнадзора о том, что новое положение вступит в силу совсем скоро. «Если ты ИП, то можешь иметь только одну аптеку, а несколько аптек могут иметь только ООО», — отмечают участники профильных чатов в телеграм-каналах. Юристы говорят, что положение действительно не дает возможности открывать ИП больше одной аптеки. По идее, документ должен распространяться лишь на открытие новых аптек, однако, как сообщают представители аптечной отрасли, некоторые представители контролирующих органов в регионах делают неофициальные заявления о возможном аннулировании действующих фармлицензий индивидуальных предпринимателей, имеющих более одной розничной точки.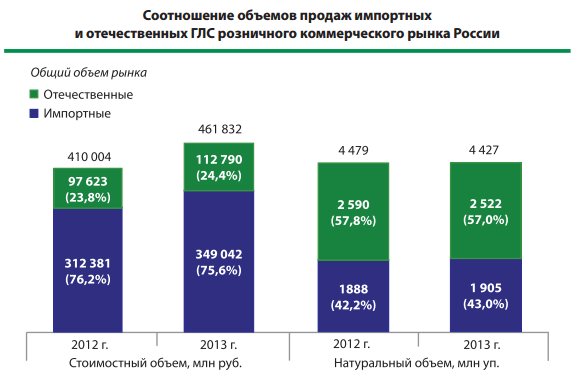
При этом, как рассказали в СРО «Ассоциация независимых аптек», проект документа, который был размещен для общественного обсуждения, в том числе с участием профессионального сообщества, не содержал такого ограничения. Кстати, двумя годами ранее индивидуальных предпринимателей исключили и из дистанционной торговли лекарственными препаратами. И вот теперь малому бизнесу приготовили новый удар, откуда не ждали. «Изо всех сил поддерживают малый бизнес, не дают ему расширяться. Выдаваят нас потихонечку», — говорит владелица аптеки в Смоленске Марина. «И это в то время, когда мы на каждом углу слышим о поддержке малого бизнеса, сохранении рабочих мест, доступности товаров первой необходимости для населения. Получается, что если собственник аптеки затеет ее перепланировку или пустит арендаторов, нужно будет переоформлять лицензию — и ИП такую аптеку потеряет», — рассказывает один из участников чата фармацевтов и провизоров.
Как рассказала «МК» индивидуальный предприниматель из Тулы Наталья Зудина, у которой 6 маленьких аптечных пунктов в селах Курской области, ее малому бизнесу, похоже, пришел конец: «Почти все аптечные ИП сегодня работают в маленьких поселках, деревнях, на окраинах городов, в районных центрах. В центрах городов давно работают федеральные сети — и нас оттуда уже вытеснили. Наши аптечные пункты никому не интересны — мы занимаемся обеспечением населения лекарственными средствами в труднодоступных местах, тут особой прибыли не сделать. Когда-то в таких населенных пунктах лекарствами жителей обеспечивали фельдшерско-акушерские пункты (ФАПы), но после развала СССР развалились и они, и люди остались без доступа к товарам первой необходимости. Они стали жаловаться, просить администрации открыть им аптеки. Но федеральным сетям это было неинтересно. Поэтому аптечные пункты стали открывать ИП. Мы является жителями таких городов, и знаем, что востребовано местным населением. И если сейчас нам, как ИП, запретят открывать новые аптечные пункты, народ опять останется без медикаментов, а мы будем ущемлены в своих правах, потому что ничего нового открывать не будем. Останемся с теми небольшими аптечными пунктами, которые есть. У меня 6 аптечных пунктов, и были планы открыть еще два в таких же маленьких поселочках.
В центрах городов давно работают федеральные сети — и нас оттуда уже вытеснили. Наши аптечные пункты никому не интересны — мы занимаемся обеспечением населения лекарственными средствами в труднодоступных местах, тут особой прибыли не сделать. Когда-то в таких населенных пунктах лекарствами жителей обеспечивали фельдшерско-акушерские пункты (ФАПы), но после развала СССР развалились и они, и люди остались без доступа к товарам первой необходимости. Они стали жаловаться, просить администрации открыть им аптеки. Но федеральным сетям это было неинтересно. Поэтому аптечные пункты стали открывать ИП. Мы является жителями таких городов, и знаем, что востребовано местным населением. И если сейчас нам, как ИП, запретят открывать новые аптечные пункты, народ опять останется без медикаментов, а мы будем ущемлены в своих правах, потому что ничего нового открывать не будем. Останемся с теми небольшими аптечными пунктами, которые есть. У меня 6 аптечных пунктов, и были планы открыть еще два в таких же маленьких поселочках.
Как рассказала «МК» директор СРО «Ассоциация независимых аптек» Виктория Преснякова, аптечным организациям в советское время уделялось большое внимание: был единый центр управления, в котором аккумулировалась вся реальная статистика, оперативно решались вопросы дефектуры лекарств, велся учет запросов на изготовление новых препаратов, лекарственных форм, велась научная и образовательная работа по направлению «Фармация» и т. д. В постсоветский период аптечное направление вынуждено было отстраиваться заново. Влияние экономического фактора привело к тому, что аптечный бизнес четко поделился на малый (средний) региональный и крупный федеральный сетевой. «Мы неоднократно говорили о том, что аптечные организации в регионах, включая труднодоступные и малонаселенные, представлены в основном малыми предприятиями и ИП.
Фармацевты считают, что если государство заинтересовано в отлаживании системы лекарственного обеспечения трудоспособного населения (не только льготных категорий), участии в этой системе профессиональных кадров, развитии малого и среднего предпринимательства в регионах в целом, а не только городах федерального значения, то принятие подобных мер недопустимо.
Подписаться
Авторы:- Екатерина Пичугина
Минэкономразвития Россия Смоленск Тула Курская область
Что еще почитать
Что почитать:Ещё материалы
В регионах
4 июня – Троица, что можно, а что строго запрещено делать в большой православный праздник
Фото 46307
ПсковВ батальоне «Крым» рассказали об использовании Украиной тактики НАТО
фото: МК в Крыму
Удар молнии не оставил выбора: история единственного учителя биологии в Чите
Фото 27785
ЧитаЭксперты объяснили популярность онлайн-сделок с готовым бизнесом в регионах
Фото 21247
Нижний НовгородАлександр Прокопенков
Жители Подмосковья выступили против благоустройства лесов
14864
Московская областьЕвгения Вокач
В Ярославской области на трассе М8 погиб известный шоумен
Фото 10895
В регионах:Ещё материалы
Аптека под ключ от экспертов БАУФАРМ [Россия и СНГ]
Аптека под ключ от экспертов БАУФАРМ [Россия и СНГ] Аптека под ключ+0%
раскрытие потенциала
Проектирование и Дизайн
+0%
продающих площадей
ПодробнееСистемы компактного хранения
+0%
экономия площадей
ПодробнееПроизводство торгового оборудования
+0%
в точности по проекту
ПодробнееКонсалтинг и Обучение
+0%
рентабельности аптек
ПодробнееАптека под ключ — это комплексные решения из взаимодополняющих друг друга услуг и оборудования. Наши БАУ-решения дают наибольшую эффективность и максимальное раскрытие потенциала аптечного бизнеса.
Наши БАУ-решения дают наибольшую эффективность и максимальное раскрытие потенциала аптечного бизнеса.
В нашей компании (БАУ-команде) мы объединили опыт и возможности экспертов разных областей, чтобы помогать Вам проще реализовывать проекты открытия аптек / аптечных сетей и всесторонне развивать фармацевтический бизнес. Мы предлагаем комплексные услуги и реализацию аптек под заказ: консалтинг, проектирование, оборудование, обучение.
Консалтинг
- Модернизация аптек и Разработка
аптек нового формата - План развития, разработка
стратегии, диагностика - Формирование стандартов
продаж, мерчендайзинга и
категорийного менеджмента - Ребрендинг
- Digital-маркетинг
Проектирование
- Разработка концепции аптек
- Оптимизация помещений аптек
- Разработка дизайна торгового
- Дизайн-проекты аптек
- Концепт-проекты фасадов и
прилегающей территории - Разработка планировки аптеки
Оборудование
- Профессиональные рецептурные
зоны СТОРЕКС (Pro) - Система компактного и адресного
хранения СТОРЕКС - Производство мебели для аптек
под заказ - Оборудование для
специализированных товаров
оптики, ортопедии, лечебной
косметики
Обучение
- Фармацевтов-первостольников
- Фармацевтов-консультантов
- Закупщиков
- Управленцев
- Маркетологов
5 преимуществ открытия аптеки под ключ от БАУФАРМ
Создание аптеки под ключ от компании БАУФАРМ – это отработанная технология открытия бизнеса с внедрением профессиональных решений и новых подходов в работе. При заказе аптеки под ключ Вы приобретаете целый набор преимуществ и ускорение развития Вашего фармацевтического бизнеса:
При заказе аптеки под ключ Вы приобретаете целый набор преимуществ и ускорение развития Вашего фармацевтического бизнеса:
1. Одним из приоритетов работы нашей компании является создание общей концепции. На этапе разработки концепции мы учитываем все аспекты и индивидуальные особенности каждой организации (коммерческие, технические, маркетинговые и др.). Работая над проектом вместе с Вашей компанией, мы становимся единой командой с общей целью — создание современной аптеки европейского уровня.
2. При реализации проекта под заказ Вы приобретаете современное оборудование от производителя, изготовленное в точности по проекту.
3. Мы внимательно относимся к деталям Вашего проекта и сопровождаем Вас на этапах его реализации до запуска бизнеса в работу, консультируя по всем вопросам в области наших компетенций.
4. Стоимость отдельно заказанных услуг и оборудования часто оказывается высокой, а качество выполнения — не соответствующее первоначальным ожиданиям. При этом требуются существенные затраты Вашего личного времени и/или ключевых сотрудников организации на коммуникацию с разными исполнителями и поставщиками. Комплексная работа вместе с нашей компанией БАУФАРМ помогает снизить ваши затраты до 34%. Множество вопросов, связанных с проектным управлением и коммуникацией с рабочей группой, мы берем на себя.
Комплексная работа вместе с нашей компанией БАУФАРМ помогает снизить ваши затраты до 34%. Множество вопросов, связанных с проектным управлением и коммуникацией с рабочей группой, мы берем на себя.
5. Для каждого Клиента мы создаем индивидуальное БАУ-решение. При заказе «Аптеки под ключ» каждый Клиент получает особые привилегии.
Ваши данные успешно отправлены.
Наш специалист свяжется с Вами в ближайшее время
WhatsApp Telegram
+7 (968) 592 57 09
Пакетные предложения «Аптека под ключ»
Для удобства Вашего выбора мы предлагаем пакетные предложения «Аптек под ключ», которые помогут определиться в многообразии БАУ-решений для аптечного бизнеса. В зависимости от задач, которые необходимо решить аптечной организации, Вы можете выбрать один из трех пакетов комплексных решений от компании БАУФАРМ. В каждом пакете вместе с базовым набором услуг и оборудования опционально (под заказ) Вы можете приобрести дополнительные БАУ-решения.
В зависимости от задач, которые необходимо решить аптечной организации, Вы можете выбрать один из трех пакетов комплексных решений от компании БАУФАРМ. В каждом пакете вместе с базовым набором услуг и оборудования опционально (под заказ) Вы можете приобрести дополнительные БАУ-решения.
Пакет услуг А
Для аптечного бизнеса с задачами полной модернизации аптек, создания нового формата (ребрендинг) и развития новых направлений
Подробнее
Пакет услуг B
Для аптечной организации, интенсивно расширяющих аптечную сеть (одновременная работа по нескольким проектам развития)
Подробнее
Пакет услуг С
Для компаний с задачами частичной реконструкции аптек
Подробнее
- • Комплексный аудит аптечной сети и разработка плана развития
- • Разработка маркетинговой концепции аптек (в рамках проекта)
- • Консалтинг по широкому кругу вопросов (в рамках проекта)
- • Разработка лого и бренд-бука (опция)
- • Функциональный план всей аптеки
- • Зонирование торговой зоны
- • План потоков покупателей
- • Дизайн торгового интерьера
- • 3D-тур или Панорама 360 (опция)
- • Технический проект
- • Дизайн фасада (опция)
- • Концепция прилегающей территории (опция)
- • Рецептурная зона СТОРЕКС (Pro)
- • Торговое оборудование с опциями
- • Спецоборудование (опция)
- • Доставка и Монтаж
- • Современные техники продаж (в рамках проекта)
- • Технологии мерчандайзинга (в рамках проекта)
- • Категорийный менеджмент (опция)
Выгода до 25%
Заказать- • Консультация по техническим вопросам
- • Рекомендации по улучшению работы
- • Консалтинг по широкому кругу вопросов (в рамках проекта)
- • Функциональный план аптек
- • Дизайн торгового интерьера (опция)
- • Технический проект
- • Система хранения СТОРЕКС
- • Рецептурная зона СТОРЕКС (Pro)
- • Торговое оборудование
- • Доставка и монтаж
- • Современные техники продаж (в рамках проекта)
- • Технологии мерчандайзинга (в рамках проекта)
- • Категорийный менеджмент (опция)
Выгода до 20%
Заказать- • Оптимизация зон хранения и улучшений торгового зала
- • Консультация по техническим вопросам
- • Рекомендации по улучшению работы в торговом зале
- • Планировка локальной зоны
- • Дизайн локальной зоны (опция)
- • Проект модернизации с существующим оборудованием (опция, по запросу)
- • Ситсема хранения СТОРЕКС или Рецептурная зона СТОРЕКС (Pro)
- • Аксессуары (опция)
- • Доставка и монтаж (опции)
- • Обучение по различным направлениям (опция, по запросу)
Выгода до 10%
Заказать Спасибо!Ваши данные успешно отправлены.
Наш специалист свяжется с Вами в ближайшее время
WhatsApp Telegram
+7 (968) 592 57 09
Кейсы аптек от экспертов БАУФАРМ
Ознакомьтесь с нашими кейсами комплексных решений для аптек после модернизации (реорганизации) аптеки или разработки аптеки нового формата.
Каждый из примеров индивидуален по глубине проработки в соответствии с бизнес-задачами Клиентов
Аптека МедикаментумВысокотрафиковая аптека рядом с метро Аптека-эксперт
Модернизация государственной аптеки Аптека B+
Первая аптека Казахстана с услугами телемедицины Уникальный дизайн для аптеки № 190 в г. Красноярск
Полная реализация аптеки Аптека Мерей
Оптимизация работы небольшой аптеки с интенсивным трафиком покупателей Центральная районная аптека в Назарово
Полная модернизация аптеки МУП Аптека маркет Medical City
Новый формат аптек в Баку Уникальный дизайн для аптеки № 190 в г.
 Красноярск
Красноярск Полная реализация аптеки Аптеки Монастырев
Организация компактного хранения Аптека Salamat
Модернизация аптеки в столице Казахстана Аптека в ветеринарной клиники | Animal Vet
Торговое оборудование для зооветцентра Аптека KRISTAL
Дизайнерская аптека с системами хранения СТОРЕКС Петербургские аптеки
Модернизация аптеки с классическом стиле Фарммаркет Инссарс
Новый формат для аптечной сети Алматы Аптечный центр На Здоровье
Флагман аптечной сети в Астрахани Каменноостровская аптека
Историческая аптека в Санкт-Петербурге Центральная аптека
Реконструкция производственной аптеки Аптечный маркет АРС
Лаконичный дизайн и выверенный функционал аптеки Аптека Euro Pharm Market
Аптека европейского уровня в городе Ташкент
Открытие фармацевтической компании в России
Российская фармацевтическая промышленность является одной из самых быстрорастущих в мире, ее ежегодный рост составляет более 10%. Являясь одним из самых прибыльных, а также динамичных и перспективных специализированных рынков, как в России, так и за рубежом, фармацевтический рынок занимает второе место по объему после рынка продуктов питания. Иностранные инвесторы должны знать, что Российская фармацевтическая промышленность является стабильной отраслью, ориентированной на внутренний рынок; он входит в первую десятку фармацевтических рынков мира.
Являясь одним из самых прибыльных, а также динамичных и перспективных специализированных рынков, как в России, так и за рубежом, фармацевтический рынок занимает второе место по объему после рынка продуктов питания. Иностранные инвесторы должны знать, что Российская фармацевтическая промышленность является стабильной отраслью, ориентированной на внутренний рынок; он входит в первую десятку фармацевтических рынков мира.
Если вы заинтересованы в создании бизнеса в фармацевтической промышленности , наши российские представители по созданию компании могут предложить юридическую помощь по этому вопросу.
Требования к регистрации при открытии российской фармацевтической компании
Важным моментом, который следует учитывать, является тот факт, что лекарственные средства могут производиться, продаваться, ввозиться и использоваться в России только в том случае, если они зарегистрированы в государственный орган, осуществляющий контроль за качеством лекарственных средств. В настоящее время эти функции предлагает Федеральная служба здравоохранения.
В настоящее время эти функции предлагает Федеральная служба здравоохранения.
С учетом этого аспекта для регистрации лекарственных средств в Федеральную службу здравоохранения представляются следующие документы и сведения:
• заявление о государственной регистрации фармацевтической компании ;
• документ об уплате государственной пошлины за регистрацию;
• юридический адрес производителя лекарственного средства;
• оригинальное название лекарственного средства при регистрации в качестве товарного знака;
• наименование лекарственного средства;
• инструкция по применению фармацевтической компании , составленная в соответствии с требованиями Закона о фармацевтике;
• сертификат качества для фармацевтического бизнеса;
• результаты фармакологических и токсикологических испытаний лекарственного средства;
• результаты клинических исследований;
• документы, подтверждающие регистрацию лекарственного препарата, если он зарегистрирован за пределами России и т. п.
п.
Вышеуказанные документы, а также другая важная информация, которая должна быть составлена на русском языке (или переведена сертифицированным русским переводчиком), имеют значение при регистрации фармацевтической компании в России . Наши российские специалисты по регистрации компании предоставят полную информацию о конкретных требованиях к процессу регистрации фармацевтического препарата в России .
Лицензирующие органы и требования к открытию аптеки в России
Закон о фармацевтике отдает приоритет государству в области контроля за производством, эффективностью, качеством и безопасностью фармацевтических препаратов. Она обеспечивает население безопасными и качественными лекарственными средствами, так как сфера здравоохранения очень важна для населения. Вот почему для компаний жизненно важно получить аптечную лицензию, которая будет гарантировать правовую среду для фармацевтической деятельности.
Документы, которые необходимо предоставить заявителю в соответствующий орган (Федеральную службу или органы исполнительной власти в субъектах РФ) для получения лицензия на аптеку :
• документы, необходимые в соответствии с лицензионным законодательством: заявление, учредительные документы, подтверждение оплаты государственной пошлины;
• документы, относящиеся к фармацевтической деятельности : данные о медицинской лицензии, копии документов, подтверждающих наличие соответствующего оборудования и помещений, копии документов, подтверждающих соответствующую квалификацию персонала, данные гигиенического сертификата и т. д.
Если вы хотите команда бухгалтеров в России , вы можете обсудить все интересующие вас аспекты с нашими специалистами. В соответствии с РСБУ и Международными стандартами финансовой отчетности (МСФО) компании, ведущие деятельность в этой стране, должны выполнять все процедуры, связанные с бухгалтерским учетом, расчетом заработной платы и аудитом. Также существует обязательство по подготовке и представлению годовой финансовой отчетности. Иностранные инвесторы, открывающие бизнес в России, также могут выбрать мониторинг долга и возврат налогов.
Также существует обязательство по подготовке и представлению годовой финансовой отчетности. Иностранные инвесторы, открывающие бизнес в России, также могут выбрать мониторинг долга и возврат налогов.
Наши представители по регистрации компаний в России предоставят вам более подробную информацию о документах и лицензиях, необходимых для регистрации фармацевтической компании в России. Если вам нужна юридическая помощь по этому вопросу, позвоните по номеру , свяжитесь с нами по номеру .
Регистрация лекарственных средств в России
Обзор регистрации лекарственных средств в России
Ожидается, что в 2020 году объем российской фармацевтической отрасли превысит два триллиона российских рублей, что примерно на 10 % больше, чем в предыдущем году. Ожидается, что к 2023 году фармацевтическая выручка достигнет 2,35 трлн российских рублей. Стоит также отметить, что сроки получения разрешений являются одними из самых быстрых в мире (Statista). Однако имейте в виду, что российское фармацевтическое законодательство не всегда соответствует международным стандартам. Это первый из двух блогов о регистрации лекарственных средств в России, посвященный:
Однако имейте в виду, что российское фармацевтическое законодательство не всегда соответствует международным стандартам. Это первый из двух блогов о регистрации лекарственных средств в России, посвященный:
- Регулирующие органы
- Надлежащая производственная практика в России
- Доклинические исследования
- Проведение локальных клинических исследований в России
- Заявка на клинические испытания в России
Предыдущее законодательство регулировалось Федеральным законом о распределении медицинских товары, принятые в 2010 году. Однако с конца 2020 года национальный процесс авторизации больше не будет действовать. В результате, существует мало законодательных и нормативных положений. Кроме того, регулирующие правила в фармацевтической промышленности часто дублируют законодательные законы, но не развивают их. Таким образом, такие нормативные оговорки можно считать излишними. Опять же, фармацевтическое законодательство отличается от других видов законодательства о продуктах медицинского назначения, таких как правила медицинского оборудования или косметики. Многие спорные элементы включены в закон. Однако они не применяются и не соблюдаются. Например, не соблюдаются юридические определения исследований биоэквивалентности или дженериков, а человеческие и ветеринарные требования объединены в одном законодательстве.
Многие спорные элементы включены в закон. Однако они не применяются и не соблюдаются. Например, не соблюдаются юридические определения исследований биоэквивалентности или дженериков, а человеческие и ветеринарные требования объединены в одном законодательстве.
Кто является органом, отвечающим за регистрационное удостоверение
По сравнению с другими странами и территориями российская нормативно-правовая база для товаров медицинского назначения достаточно фрагментирована. Регистрацией лекарственных средств в России занимаются как минимум четыре отдельных компетентных органа.
Минздрав России
Минздрав России отвечает за выдачу регистрационного удостоверения, подачу заявок на проведение клинических исследований и контроль цен на отдельные лекарственные средства, включенные в Российский перечень основных лекарственных средств. Кроме того, в Министерстве здравоохранения есть специальное государственное учреждение; ФГБУ. Это учреждение оценивает досье заявки на получение торговой лицензии и другие типы досье, такие как досье заявки на клиническое испытание, досье изменения или обновления.
Это учреждение оценивает досье заявки на получение торговой лицензии и другие типы досье, такие как досье заявки на клиническое испытание, досье изменения или обновления.
Минпромторг России
Вторым государственным органом, важным для регулирования лекарственных средств для человека, является Минпромторг. Это учреждение отвечает за выдачу разрешений производителей для местных предприятий и сертификацию GMP производственных мощностей в России и за рубежом.
Росздравнадзор
Следующим важным игроком в сфере регулирования является Росздравнадзор, российская аббревиатура Федерального агентства по надзору в сфере здравоохранения и социального развития. Это заведение:
- зарубежный фармаконадзор за фармацевтическими препаратами для человека
- проводит инспекции GCP
- проводит инспекции GLP (ограничено лекарствами для человека)
- отвечает за тестирование официального выпуска партии
Федеральная антимонопольная служба Сервис завершает список основных регуляторов лекарств для человека в России. Он регулирует рекламу фармацевтических препаратов на зарубежных рынках и устанавливает цены на лекарства, входящие в российский перечень основных лекарственных средств. Кроме того, он играет решающую роль в процессе принятия решений, связанных с разработкой нового фармацевтического законодательства.
Он регулирует рекламу фармацевтических препаратов на зарубежных рынках и устанавливает цены на лекарства, входящие в российский перечень основных лекарственных средств. Кроме того, он играет решающую роль в процессе принятия решений, связанных с разработкой нового фармацевтического законодательства.
Надлежащая производственная практика в России
Аккредитация GMP является серьезной проблемой для иностранных фармацевтических компаний. Чтобы подать заявку на получение регистрационного удостоверения в России, вы должны иметь действующий сертификат надлежащей производственной практики (GMP) в Российской Федерации; зарубежные сертификаты GMP не признаются. Не имеет значения, находится ли производитель в государстве-члене ICH или PIC/S.
Однако в качестве подтверждения соответствия российским требованиям GMP принимается сертификат GMP, выданный государством-членом Евразийского экономического союза (ЕАЭС) (Беларусь, Казахстан, Армения или Кыргызстан). Инспекция GMP находится в Министерстве промышленности и торговли; это отдельная государственная организация, известная как Федеральное бюджетное учреждение, отвечающее за Государственный институт лекарственных средств и надлежащей практики.
Инспекция GMP находится в Министерстве промышленности и торговли; это отдельная государственная организация, известная как Федеральное бюджетное учреждение, отвечающее за Государственный институт лекарственных средств и надлежащей практики.
Процесс подачи заявки на инспекцию не связан с выдачей разрешения на продажу. Если сертификат GMP, выданный Министерством промышленности и торговли, не существует, заявление на получение маркетинговой лицензии все же может быть подано, если предприятие предоставит подтверждение от Фармацевтической инспекции о том, что проверка будет проводиться в будущем. В этой ситуации регистрационное удостоверение будет отложено до тех пор, пока вы не предоставите действующий сертификат GMP после оценки Российской инспекцией GMP.
Каковы российские GMP по сравнению с ЕС?
Приказ GMP для России основан на правилах Надлежащей производственной практики Европейского Союза, которые содержатся в EudraLex – Том 4. В частности, были переведены Глоссарий, Части I–III и Приложения Части I. Однако были внесены различные коррективы, в результате чего между российскими нормами и нормами ЕС возникли небольшие расхождения.
В частности, были переведены Глоссарий, Части I–III и Приложения Части I. Однако были внесены различные коррективы, в результате чего между российскими нормами и нормами ЕС возникли небольшие расхождения.
Следует отметить, что при разработке русскоязычной версии GMP правительство уделяло первостепенное внимание техническим компонентам надлежащей производственной практики, в основном игнорируя процедурные. Это привело к процессуальной двусмысленности, которую необходимо исправить.
Например, в Приказе GMP отсутствуют положения, аналогичные положениям, включенным в Разделы IV и XI Директивы 2001/83/ЕС, Директиве Европейского Союза 1572/2017, а также национальные требования государств-членов ЕС, такие как те, которые содержатся в Положение о лекарственных средствах для человека 2012 г.
Сроки получения российского сертификата GMP
В связи с тем, что законы GMP вступили в силу сравнительно недавно, количество заявок на получение сертификатов GMP превысило оперативные возможности Инспекции, в результате чего сформировался лист ожидания с огромным период ожидания от шести до двенадцати месяцев.
Поэтому крайне важно изучить сертификацию GMP заблаговременно до подачи заявки на разрешение на продажу. Кроме того, сертификаты необходимо продлевать не реже одного раза в три года, а также требуются проверки для продления. Тем не менее, объем проверки может быть установлен риск-ориентированным подходом.
Министерство здравоохранения отклонит заявку на получение разрешения на продажу, если соответствующие производственные мощности не были проверены на соответствие GMP. Прежде чем запрашивать маркетинговую лицензию, заявитель должен согласовать и утвердить дату проверки с Министерством промышленности и торговли и Инспекцией GMP.
Иногда иностранные производители готовой продукции могут столкнуться с трудностями при проверке конкретного продукта, так как основной документ контроля качества в России является нормативным документом, который часто отличается от спецификации производителя.
Нормативный документ в России
Основанием для нормативного документа является Российская государственная фармакопея, не гармонизированная с другими фармакопеями; также оценщики часто дают рекомендации по улучшению аналитических процедур нормативного документа. Эти предложения, однако, основаны на результатах тестирования, полученных в официальной лаборатории, которая не проводит валидацию или передачу метода при проверке процедур тестирования заявителя. Наши специалисты с удовольствием обсудят с вами действенный способ облегчить эту процедуру, помогут минимизировать риски и преодолеть препятствия, связанные с получением свидетельства о регистрации лекарственных средств в России.
Эти предложения, однако, основаны на результатах тестирования, полученных в официальной лаборатории, которая не проводит валидацию или передачу метода при проверке процедур тестирования заявителя. Наши специалисты с удовольствием обсудят с вами действенный способ облегчить эту процедуру, помогут минимизировать риски и преодолеть препятствия, связанные с получением свидетельства о регистрации лекарственных средств в России.
Доклинические исследования для регистрации лекарственных средств в России
Данные доклинических исследований могут потребоваться в некоторых ситуациях при подаче заявки на клиническое исследование, при подаче заявки на получение регистрационного удостоверения или при продлении/продлении срока действия медицинского изделия. Тем не менее, есть несколько уникальных трудностей. Во-первых, федеральные правила требуют, чтобы все неклинические эксперименты проводились в соответствии с GLP.
Таким образом, неклинические исследования PD и PK также должны соответствовать стандартам GLP; это обычно неосуществимо. Однако, поскольку это соответствие обычно не контролируется регулирующим органом, до сих пор не возникло никаких трудностей в связи с этой проблемой. Тем не менее, имейте в виду, что вы должны адекватно объяснить это регулирующим органам или оценщикам в случае наблюдений. Необходимо отметить, что в России действуют две системы GLP, которые не согласуются друг с другом:
Однако, поскольку это соответствие обычно не контролируется регулирующим органом, до сих пор не возникло никаких трудностей в связи с этой проблемой. Тем не менее, имейте в виду, что вы должны адекватно объяснить это регулирующим органам или оценщикам в случае наблюдений. Необходимо отметить, что в России действуют две системы GLP, которые не согласуются друг с другом:
- Общие законы GLP, которые соответствуют рекомендациям GLP ОЭСР
- Во-вторых, существует Приказ GLP для конкретных фармацевтических препаратов, который представляет собой значительно сокращенную версию стандартов GLP ОЭСР.
Поскольку рекомендации OECD GLP охватывают российские правила GLP, относящиеся к фармацевтическим препаратам, в этой области не должно возникнуть проблем, если заявитель следует рекомендациям OECD GLP при проведении доклинических исследований.
Следующая возможная проблема связана с необходимостью для общих или гибридных приложений предоставлять данные неклинических испытаний. (В некоторых случаях гибридные приложения называются IMD или поэтапно модифицированными лекарствами.) Хотя эта потребность устарела и в некоторых случаях может быть заменена подробными библиографическими данными, аналогичные наблюдения продолжают появляться и могут быть рассмотрены с помощью подробных объяснений и библиографических данных. . Обычно требуется две-четыре недели испытаний на подострую токсичность и местную переносимость. Естественно, предпочтительнее решить эти проблемы и изучить ваши варианты продолжения лечения без дополнительного тестирования in vivo.
(В некоторых случаях гибридные приложения называются IMD или поэтапно модифицированными лекарствами.) Хотя эта потребность устарела и в некоторых случаях может быть заменена подробными библиографическими данными, аналогичные наблюдения продолжают появляться и могут быть рассмотрены с помощью подробных объяснений и библиографических данных. . Обычно требуется две-четыре недели испытаний на подострую токсичность и местную переносимость. Естественно, предпочтительнее решить эти проблемы и изучить ваши варианты продолжения лечения без дополнительного тестирования in vivo.
Местные клинические испытания
Российские нормативные акты требуют, чтобы как минимум одно клиническое исследование было проведено в российских клинических учреждениях. Однако в многоцентровых исследованиях может быть добавлен один российский центр в соответствии с местными требованиями к клиническим испытаниям.
Положение прямо исключает возможность тиражирования или реализации полной программы клинических исследований в России. Кроме того, нет обязательства проводить всю фазу (т. е. многочисленные КИ) программы клинической разработки. Наконец, клинические испытания считаются исследованиями биоэквивалентности. В связи с тем, что исследование биоэквивалентности редко бывает целесообразным разделить на несколько клинических центров, полное исследование должно быть проведено или повторено в России для дженериков. В других обстоятельствах наиболее целесообразной альтернативой является международное многоцентровое клиническое исследование.
Кроме того, нет обязательства проводить всю фазу (т. е. многочисленные КИ) программы клинической разработки. Наконец, клинические испытания считаются исследованиями биоэквивалентности. В связи с тем, что исследование биоэквивалентности редко бывает целесообразным разделить на несколько клинических центров, полное исследование должно быть проведено или повторено в России для дженериков. В других обстоятельствах наиболее целесообразной альтернативой является международное многоцентровое клиническое исследование.
Одновременно не допускаются исследования ранней фазы (фаза 1) на здоровых участниках с использованием материалов для клинических исследований, произведенных за рубежом. Эти положения защищают здоровых людей от испытаний ранее не испытанных химических веществ на здоровых российских людях. Однако такие исследования допустимы, когда в них участвуют пациенты. Таким образом, если желательно провести исследование фазы 1 на здоровых добровольцах, предпочтительнее найти российского партнера, способного выполнить хотя бы один этап производства (например, упаковку).
Клинические испытания должны проводиться в соответствии с Российским приказом GCP, который основан на ICH GCP(R1), но является менее строгим. Однако, несмотря на то, что соблюдение GCP не имеет решающего значения для Министерства здравоохранения и экспертов, простой декларации о соответствии может быть достаточно.
Когда в России нет необходимости в клинических исследованиях?
Заявители освобождаются от обмена данными местных клинических испытаний в ряде случаев. Таковы обстоятельства, предусмотренные статьей 18 Федерального закона.
Если вы проводили исследование в БеларусиИнтересно, что связь между Россией и Беларусью заметна в регистрации лекарств в России. Если клиническое исследование проводилось в Беларуси, такое исследование считается локальным клиническим исследованием, поскольку Россия имеет тесную связь с этой республикой.
Дженерики Кроме того, некоторые дженерики освобождены от требования предоставления данных клинических испытаний, чтобы соответствовать определенным критериям биовейвера, будь то местные или национальные. Например, пероральные или парентеральные растворы или медицинские газы могут быть разрешены только после получения данных о фармацевтической эквивалентности. Дополнительные сильные стороны также могут быть одобрены без клинических данных, хотя такой вид биовейвера не разрешен федеральными стандартами. Поскольку в регламенте нет формальных критериев биовейвера повышенной прочности, эксперты должны определять применимость этого вида биовейвера на индивидуальной основе.
Например, пероральные или парентеральные растворы или медицинские газы могут быть разрешены только после получения данных о фармацевтической эквивалентности. Дополнительные сильные стороны также могут быть одобрены без клинических данных, хотя такой вид биовейвера не разрешен федеральными стандартами. Поскольку в регламенте нет формальных критериев биовейвера повышенной прочности, эксперты должны определять применимость этого вида биовейвера на индивидуальной основе.
Во-первых, орфанные лекарственные препараты освобождаются от локальных клинических исследований, поэтому локальные клинические данные не требуются, если лекарственный препарат признан в России орфанным.
Комбинированные продукты Для некоторых комбинированных продуктов дополнительные клинические данные не требуются, как это предусмотрено законодательством. В этих случаях библиографических данных может быть достаточно. Местные клинические испытания также не нужны, если для зарегистрированного лекарственного средства добавляются новые способы применения или показания.
Заявка на регистрацию ЛС в России
Продолжительность процедуры СТА составляет всего 30 рабочих дней, а требования к заявке на клиническое исследование достаточно свободны. Например, не требуется досье на исследуемый лекарственный препарат. вам нужно только предоставить клинические документы, касающиеся досье заявки на клиническое исследование, такие как:
- Протокол исследования
- Брошюра исследователя
- Форма информированного согласия
- Форма отчета о болезни
- Страховой полис
- И т. д.
Наличие сертификата соответствия качества исследуемого продукта достаточно в досье СТА. Досье на исследуемые лекарственные препараты или другие документы, достаточно подробно описывающие аспекты качества исследуемого препарата, не требуются. Как правило, научные стандарты планирования и проведения клинических исследований соответствуют международно признанным подходам, изложенным в руководствах и методических документах ICH, EMA, ВОЗ или FDA.
